乐虎lehu唯一官网医药(600196.SH;02196.HK)宣布,获许可产品注射用A型肉毒毒素(中国境内商标:达希斐®、英文商标:DAXXIFY ®,项目代号:RT002,以下简称“该产品”)的成人颈部肌张力障碍(Cervical Dystonia,简称CD)适应症注册申请近日已获国家药品监督管理局(“国家药监局”)批准,这是达希斐®
获批的第二个适应症。达希斐®的专利配方含有纯150kd核心神经毒素和专利肽辅料RTP004,不含动物蛋白或其他辅助蛋白。
乐虎lehu唯一官网医药控股子公司上海乐虎lehu唯一官网医药产业发展有限公司(“乐虎lehu唯一官网医药产业”)于2018年12月获美国Revance Therapeutics, Inc.许可于区域内(即中国内地、香港及澳门特别行政区)独家进口、使用、开发及商业化(不包括制造)该产品。该产品为DaxibotulinumtoxinA-lanm,拟用于美容适应症,暂时性改善成人因皱眉肌和/或降眉间肌活动引起的中度至重度眉间纹;以及治疗适应症,治疗成人颈部肌张力障碍。
2024年9月,达希斐 ® 美容适应症获国家药品监督管理局(“国家药监局”)批准 ,用于暂时性改善成人因皱眉肌和/或降眉间肌活动引起的中度至重度眉间纹,作为20多年来同类产品的首次创新,达希斐 ® 采用其专有的肽交换技术(Peptide Exchange Technology,PXT)开发的含有稳定肽制剂和高度纯化的A型肉毒毒素的新一代神经调节剂,为广大患者提供卓越的疗效。
1
颈部肌张力障碍患者疗程
间隔期内症状复发非常普遍

颈部肌张力障碍(Cervical dystonia,CD)是一种慢性神经系统疾病,是临床最常见的局灶性肌张力障碍疾病之一。其特征是颈部肌肉的自发性不自主收缩,导致头部、颈部和肩部的异常运动或姿势改变1。国内外指南共识均推荐“A型肉毒毒素”作为CD的一线治疗选择2,3。目前全球范围内已有多款肉毒毒素制剂上市,出于多次重复注射引起免疫原性的担心,目前肉毒毒素制剂产品的注射疗程一般建议至少间隔3个月(12周)4,但CD患者疗程间隔期内症状复发较为普遍,复发平均时间约为10.5周,在每个疗程末期满意程度较低,是CD患者的常见问题5。
2
中位疗效持续时间达24周,
达希斐®持久改善患者症状

达希斐 ® 于2023年8月14日获得美国FDA批准,用于治疗颈部肌张力障碍6,其治疗CD的III期临床研究(ASPEN-1)于今年2月发表在《Journal of Neurology》杂志上7。全球III期和中国III期临床研究(ASPEN-CN)的汇总研究以摘要形式在今年运动障碍协会(MDS)年会上发表8。研究结果证实了达希斐 ® 在中度至重度原发性颈部肌张力障碍成人中的疗效和安全性,中位疗效持续时间可达24周,与其在眉间纹的III期临床研究和上肢痉挛的II期研究结果中表现出的“长效”特征一致,中位疗效持续为24~28周9-11。达希斐 ® 作为全球首款专利肽类长效A型肉毒毒素制剂,有望解决CD患者治疗中疗程间期内症状复发普遍这一未满足需求,进一步提高患者生活质量,减少每年的治疗次数。
ASPEN-1是一项国际多中心、随机、双盲、安慰剂对照研究7(clinicaltrials注册号:NCT03608397),共招募患者301人。ASPEN-1-CN在中国进行,研究设计与ASPEN-1相同。ASPEN-1和ASPEN-CN汇总分析共纳入患者357人8,其中含中国III期患者56人,占分析人群的15.7%。汇总分析结果显示,与安慰剂相比,第4周和第6周多伦多西方痉挛性斜颈评分量表(TWSTRS)总分较基线的变化均值(DAXI 125U组为-12.0,DAXI 250U组为-11.9)均有统计学差异(p<0.0001),两种剂量均能显著降低TWSTRS总分,改善患者症状。中位疗效持续时间(定义为从开始治疗到TWSTRS总分改善疗效损失到最小剩余益处(“minimum residual benefit”,即TWSTRS总评分改善的峰值治疗效果损失超过80 %)的时间)(95%CI)分别为:达希斐 ® 250U:22.0(20.1,24.3)周 ;达希斐 ® 125U:24.1(20.6,28.9)周(见图1)。安全性方面,大多数治疗中出现的不良事件(TEAE)为轻度或中度。治疗组中吞咽困难发生率4.5-4.7%,肌无力发生率4.5-5.4%,低于既往获批的用于CD治疗的其他A型肉毒毒素产品的关键临床研究数据4,12,13。
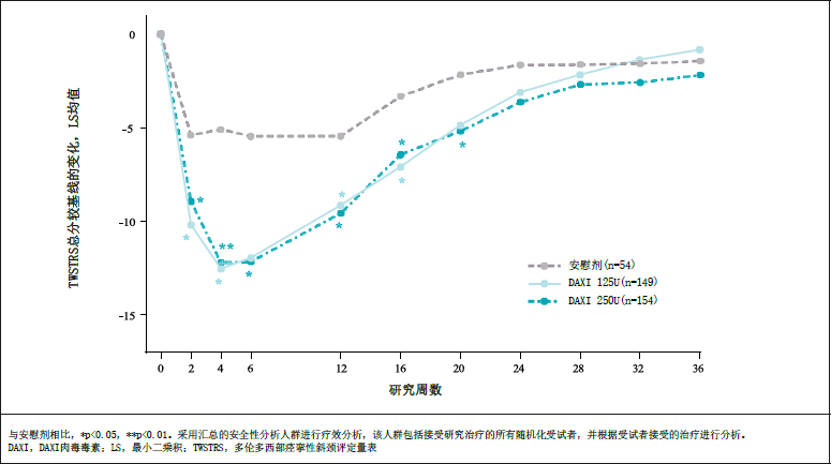
图1. 达希斐®用于治疗CD的TWSTRS总分与基线相比随时间的变化
3
达希斐®未来可期

多位专家对达希斐®获批CD适应证表示热烈祝贺,并对其在我国肉毒毒素疾病治疗领域中的应用前景寄予厚望。
万新华教授
北京协和医院,中国神经科学学会神经毒素分会名誉主任委员,达希斐®中国III期临床研究(ASPEN-1-CN)主要研究单位PI
“
III期临床研究证实了达希斐®的疗效和安全性,尤其持续时间能达到24周是非常不错的结果。事实上,肉毒毒素有着非常广泛的疾病治疗应用前景,如肌张力障碍、自主神经系统疾病、神经病理性疼痛等。期待这款新的A型肉毒毒素的获批,可以造福中国更多患者。
靳令经教授
同济大学附属养志康复医院,中国神经科学学会神经毒素分会主任委员,达希斐®中国III期临床研究(ASPEN-1-CN)参与研究单位PI
达希斐®获批CD适应证为CD患者带来更多治疗选择。达希斐®中位疗效持续时间达24周、持久改善患者症状,对于改善患者长期治疗的依从性,进一步提高患者生活治疗很有意义。同时,其制剂组成“不含动物蛋白,不含辅助蛋白,只含核心神经毒素和专利肽赋形剂RTP004”,为“继发性无应答”的患者带来全新的治疗选择。










扫一扫